La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha delineado el marco regulatorio y las responsabilidades para la comunicación y autorización de medicamentos a base de alérgenos, ya sea diagnósticos o de inmunoterapia, independientemente de su origen o proceso de producción. Aquí te presentamos los puntos clave del Q&A de la AEMPS:
1. Responsabilidad TAC: El Titular de una Autorización de Comercialización (TAC) será el único responsable del medicamento.
2. Base Legal: La elección de la base legal depende de la documentación de soporte y es responsabilidad del solicitante. La AEMPS ofrece asesoramiento científico para discutir la idoneidad de la base legal y el diseño de estudios clínicos antes de presentar la solicitud de registro.
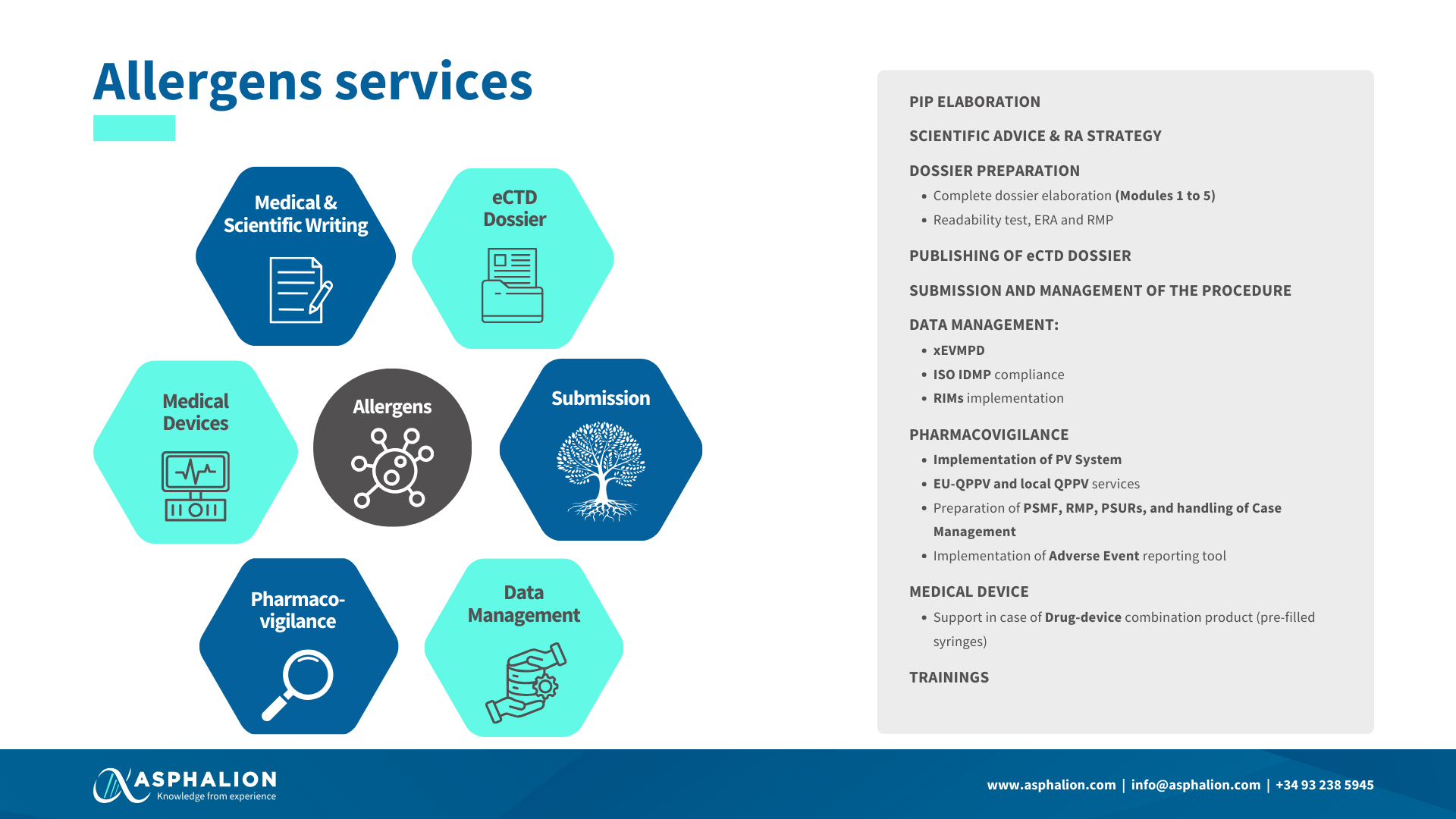
3. Dossier de Registro: para productos alérgenos usados en terapia o diagnóstico in vivo de alergias comunes Se deberán cumplir los requisitos actuales basados en el artículo 8.3 de la Directiva 2001/83/CE. Esto implica la presentación de todos los módulos, así como la presentación de información del producto propuesta (FT/Pil/ Etiquetado) en formato eCTD (“Presentation and format of the dossier Common Technical Document (CTD)”). Los graneles de alérgenos pueden presentarse en formato NeeS.
4. Estudios Clínicos: Se recomienda basar el diseño de los estudios clínicos en las guías de la EMA, y se deben cumplir con los requisitos legales para la autorización de medicamentos a base de alérgenos.
Para productos con un número limitado de pacientes, se acepta una combinación de estudios clínicos limitados y referencias bibliográficas, con datos puente necesarios.
Se desaconsejan las solicitudes bibliográficas para productos biológicos según el artículo 10a de la Directiva 2001/83/CE, debido a la complejidad de demostrar eficacia y seguridad con literatura.
5. Estabilidad: A la hora de justificar la estabilidad se deberán seguir las recomendaciones de la “Guideline on allergen products: production and quality issues” (EMEA/CHMP/BWP/304831/2007) o en su caso, justificar con datos propios o de la literatura que las mezclas son estables.
6. Fichas técnicas: Cada medicamento requiere una ficha técnica autorizada, pudiendo ser conjunta para el “mismo producto” según cada caso. No se podrán «agrupar» fichas técnicas para productos de alérgenos homólogos o por dosis.
7. Test de legibilidad: Se harán en población española, con posibilidad de estudios puente basados en tests de otros estados miembros de la UE.
8. Plan de investigación pediátrico (PIP): Se requiere un plan PIP para las solicitudes de autorización de comercialización, con posibilidad de exención o uso de datos bibliográficos justificados.
9. Procedimientos de Evaluación y Autorización: Se establecen los plazos y procedimientos en la Directiva 2001/83/CE, Capítulo 3, Art 17.1, el cual establece 210 días como plazo máximo para conceder una autorización de comercialización. A destacar que mientras dure la evaluación los alérgenos pueden continuar en el mercado.
10. Tasas de Registro: Durante la fase de regularización, se aplicará la tasa tipo 1.03 del Grupo I “Autorización e inscripción en el registro de un expediente simplificado” (1.131,59 €*) para medicamentos a base de alérgenos y la tasa tipo 1.21 del Grupo I “Graneles de alérgenos” (877,27 €*) para los graneles de alérgenos.
*Última actualización: 28 de junio de 2023
11. Medicamentos Individualizados: No necesitan registro a menos que su preparación sea repetida, en cuyo caso se considerarán de fabricación industrial.
Para obtener más información sobre estas regulaciones y cómo pueden afectar a su empresa, contáctenos a: [email protected]
Le ayudaremos a navegar por estos cambios y nos aseguraremos de que esté preparado para cumplir con los estándares regulatorios.
Puede leer el cuestionario completo aquí: PDF Q&As AEMPS